电化学相关参数及计算方法
1. 电化学相关参数
氧化还原电位:是用来反映水中所有物质表现出来的宏观氧化-还原性。氧化还原电位越高,氧化性越强,电位越低,氧化性越弱。电位为正表示溶液显示出一定的氧化性,为负则说明溶液显示出还原性。
电压、槽压:电解槽接通电流后的整体电压,单位是V。
电流:一般指提供给电解槽的电流,单位是A。
电流密度:单位面积上的电流,单位一般是mA/cm2、A/m2,1mA/cm2=10 A/m2。
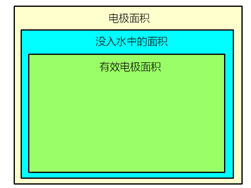
有效电极面积:不是没入水中的电极面积,也不是电极本身的面积,而是参与电化学反应的电极的面积,该数值只算阳极或者只算阴极,单位是cm2、m2。

![]()
电量:电荷的数量叫电量,用符号Q表示,单位是库伦C或Ah,1Ah=3600C。为计算方便,使用Ah较多,1mol电子所带的电量=26.8Ah。
2.电化学相关计算方法
在处理废水时,电化学的相关参数一般是基于1t废水。因此,需要一些单位换算,相关参数的计算也应该以此为基准。
2.1电量
计算公式:电量Q=It/V。
电解槽开1A的电流,1h处理 1t废水,那么供给这1t废水的总电量就是1Ah/t。
2.2 电流效率与COD去除数
COD(Chemical Oxygen Demand),即化学需氧量,是能被强氧化剂氧化的物质的氧当量,单位是mg/L。例如,某废水中可被强氧化剂氧化的物质的氧当量是300mg/L,那么该废水COD=300mg/L。
电解废水时,理论COD去除数的计算,基于O2的得电子反应。根据COD的定义,COD的数值相当于有机物A与O2的燃烧反应:
A+O2=B+2O2-
此时,所有的O2由0价变为-2价。因此,1mol的O2,得到4mol的电子,需要供给4*26.8=107.2Ah的电量。1mol的O2的质量是32g,那么1mg的O2,对应的电量=107.2/32000=0.00335Ah。所以,1Ah的电量对应1/0.00335=298.5mg的O2。即,给1L废水提供1Ah电量,理论上COD去除数=298.5mg/L。
电流效率可以用实际降解COD与理论值降解COD的比值衡量。电极表面的电化学反应,除了降解COD之外,还有析氧、析氯等副反应,所以实际降解的COD比理论值要少。例如,给1L水提供1Ah电量,COD的去除数是100mg/L,那么此时电流效率=100/298.5*100%=33.55%。当COD的实际去除数高于理论值,即电流效率高于100%时,一定是还有其他作用的参与,比如气浮、絮凝等。
2.3 能耗与COD去除数
能耗计算公式:单位能耗W=UIt/V。
W,单位Wh•L-1;U,单位V;I,单位A;t,单位h;V,单位L。
单位换算:1W=1VA,1 Wh•L-1=1VAh•L-1,1kWh•m-3=1000Wh•m-3=1000Wh•1000L-1=1Wh•L-1;对于废水1m3≈1t,所以1度电每吨=1 Wh•L-1。
表COD去除数与能耗的计算例表
时间/h | 0.25 | 0.5 | 0.75 | 1 |
电流/A | 2 | 2 | 2 | 2 |
电压/V | 4 | 4 | 4 | 4 |
水量/L | 0.5 | 0.5 | 0.5 | 0.5 |
电量/Ah •L-1 | 1 | 2 | 3 | 4 |
能耗/Wh•L-1 | 4 | 8 | 12 | 16 |
能耗/度每吨 | 4 | 8 | 12 | 16 |
理论COD去除/mg•L-1 | 298.5 | 597 | 895.5 | 1194 |
电压为4V,电流效率为100%时,4度电理论COD的去除数是298.5mg•L-1;电压为5V,5度电理论COD的去除数是298.5 mg•L-1;依此估算,若电压为4V,每吨水去除200mg•L-1的COD,电流效率为100%时,理论上需要约2.7度电。
在实际电解时,电压与水质有关,电导率越高,电压越低,能耗越低。另一方面,电流效率一般都低于100%,所以实际能耗要除以电流效率。例如,电流效率为30%时,若电压为4V,每吨水去除200mg•L-1的COD,理论上需要约2.7度电,实际需要2.7/30%=9度。
2.4电芬顿溶铁量计算
电芬顿的最大优势就是溶铁量的精确可控,原因是当电极、电解槽设计合理,电解条件控制适当时,阳极几乎没有副反应,溶铁反应的电流效率可达到100%。阳极溶铁的反应为:
Fe-2e-=Fe2+
1molFe变成1mol Fe2+,需要2mol电子,即2*26.8=53.6Ah。1mol Fe的质量是56g,所以1Ah电量溶出的Fe2+为18.7mmol=1.04g。